肿瘤分子机理与靶向疗法研究组揭示干细胞因子受体的新功能及转化医学意义
干细胞因子受体C-KIT是一种受体酪氨酸激酶,在造血干细胞、肺干细胞、肥大细胞、生殖细胞、黑素细胞、星形间质细胞及胃肠间质细胞等的生存、增殖和抗凋亡过程中发挥重要作用,其突变与白血病、胃肠间质瘤等恶性肿瘤的发生密切相关。但是,C-KIT赋予癌细胞逃逸凋亡的机制仍不清楚,如何针对C-KIT开展有效的靶向疗法也亟需进一步研究。日前,《美国国家科学院院刊》(Proceedings of the National Academy of Sciences, PNAS)发表了由中国科学院动物研究所、广州生物医药与健康研究院、上海血液学研究所、解放军总医院、第二炮兵总医院的合作研究成果,揭示了C-KIT的新功能及其医学转化的意义。
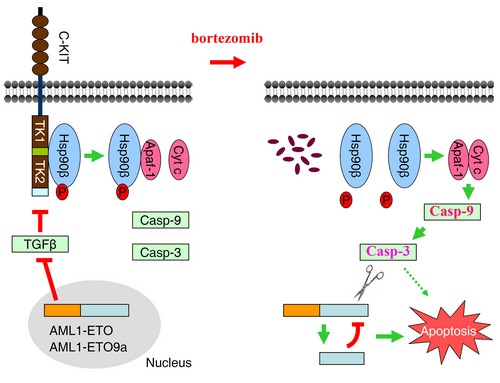
在这篇论文,作者巧妙地运用抑制C-KIT内吞的化合物戴纳索尔(Dynasore)、蛋白酶体抑制剂硼替佐米(bortezomib)和酪氨酸激酶抑制剂伊马替尼作为化学探针,研究了C-KIT内吞与癌细胞凋亡的关系,发现C-KIT可与热休克蛋白Hsp90β结合并使其发生磷酸化,而磷酸化的Hsp90β又与凋亡触动因子Apaf-1结合,抑制其活化“凋亡刽子手”Caspase-3的功能,使癌细胞逃逸凋亡。硼替佐米则可使C-KIT发生内吞并在溶酶体发生降解,使Hsp90β解离并发生去磷酸化,导致被扣押的Apaf-1释放出来并与细胞色素C结合,活化Caspase-3。在白血病干细胞,活化的Caspase-3并不能引起明显的凋亡,但其可对融合蛋白AML1-ETO及AML1-ETO9a进行切割,产生具有肿瘤抑制活性的剪切片段,后者抑制全长融合蛋白的功能,使白血病干细胞发生凋亡。在白血病小鼠模型,硼替佐米显示出显著的治疗作用,显示出这种疗法的临床应用价值。
中国科学院动物研究所的方海同和张波博士是本文共同第一作者,周光飚研究员和上海血液学研究所陈竺、陈赛娟院士是本文的共同通讯作者。该研究得到科技部国家重点基础研究973计划、国家自然科学基金和中国科学院知识创新重点项目的资助(原文链接)。(肿瘤分子机理与靶向疗法研究组/文、图)